氰化钙
外观
| 氰化钙 | |
|---|---|
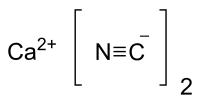
| |
| IUPAC名 Calcium cyanide | |
| 识别 | |
| CAS号 | 156-62-7 |
| PubChem | 4685067 |
| ChemSpider | 10669887 |
| SMILES |
|
| InChI |
|
| InChIKey | STRTXDFFNXSZQB-UHFFFAOYAA |
| UN编号 | 1403 |
| EINECS | 205-861-8 |
| RTECS | GS6000000 |
| 性质 | |
| 化学式 | CaCN2 |
| 摩尔质量 | 80.102 g/mol g·mol⁻¹ |
| 外观 | 白色固体(不纯时呈灰黑色) |
| 气味 | 无味 |
| 密度 | 2.29 g/cm3 |
| 熔点 | 1340 °C [1] |
| 沸点 | 1150-1200 °C (升华) |
| 溶解性(水) | 反应 |
| 危险性 | |
| 警示术语 | R:R22 R37 R41 |
| 安全术语 | S:S2 S22 S26 S36/37/39 |
| MSDS | ICSC 1639 |
| 欧盟编号 | 615-017-00-4 |
| 欧盟分类 | 有害 (Xn) 刺激性 (Xi) |
| NFPA 704 | |
| 闪点 | 非易燃 |
| 相关物质 | |
| 相关化学品 | 氰化钠 氰氨化钙 电石 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氰化钙(化学式:Ca(CN)2),无色或白色粉末,工业品呈灰黑色,味苦,有剧毒。
性质
[编辑]溶于水和弱酸,生成氰化氢(HCN);暴露于潮湿空气中也会放出剧毒气体。
和硫反应产生硫氰酸钙:
- Ca(CN)2 + S → Ca(SCN)2
制备
[编辑]可用氰氨化钙与碳共热至1000℃以上而得。
安全
[编辑]摄入后会和其他的氰化物一样,当这化合物被吸收进血液时,当中的氰离子即时进入所有细胞中,而且抑制在细胞中的线粒体中的细胞色素氧化酶(a3),引致在呼吸作用中,电子传递链不能顺利进行,从而使细胞无法藉需氧呼吸获得能量,引致细胞只能进行缺氧呼吸以维持生命活动,造成细胞窒息。
此外,由于所有细胞都只能进行缺氧呼吸,肝脏细胞又无法进行需氧呼吸以把缺氧呼吸得出的乳酸氧化或转变成糖原,引致乳酦积累在血液中,造成血液的pH值下降,引致代谢性酦中毒。血液中pH值的进一步下降更加把身体细胞中大部分的酶进一步抑制,使身体机能瘫痪,引致死亡。
吸入、口服或经皮吸收可引起急性中毒,大剂量吸入会死亡。
参考资料
[编辑]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

