苯胺
此條目需要補充更多來源。 (2022年11月3日) |
| 苯胺 | |||
|---|---|---|---|
| |||
| 別名 | 氨基苯、阿尼林油 | ||
| 識別 | |||
| CAS號 | 62-53-3 142-04-1((鹽酸鹽)) | ||
| PubChem | 6115 8870((HCl)) | ||
| ChemSpider | 5889 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | PAYRUJLWNCNPSJ-UHFFFAOYAP | ||
| ChEBI | 17296 | ||
| DrugBank | DB06728 | ||
| KEGG | C00292 | ||
| 性質 | |||
| 化學式 | C6H7N | ||
| 摩爾質量 | 93.126 g·mol⁻¹ | ||
| 外觀 | 無色液體 | ||
| 密度 | 1.0217 g/ml(液) | ||
| 熔點 | −6.3 °C | ||
| 沸點 | 184.13 °C | ||
| 溶解性(水) | 3.6 g/100 mL,20 °C | ||
| pKa | 27(共軛酸的pKa = 4.87) | ||
| pKb | 9.40 | ||
| 黏度 | 3.71 cP(25 °C) | ||
| 熱力學 | |||
| ΔcHm⦵ | -3394 kJ/mol | ||
| 危險性 | |||
| 歐盟危險性符號 | |||
| 警示術語 | R:R23/24/25-R40-R41-R43-R48/23/24/25-R68-R50 | ||
| 安全術語 | S:S1/2-S26-S27-S36/37/39-S45-S46-S61-S63 | ||
| NFPA 704 | |||
| 相關物質 | |||
| 相關芳香胺 | 1-萘胺、2-萘胺 | ||
| 相關化學品 | 苯肼、亞硝基苯、硝基苯 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
苯胺(英語:Aniline)又稱阿尼林油、氨基苯,分子式:C
6H
7N(結構簡式:C
6H
5NH
2),分子量:93.128,CAS編號:62-53-3。苯胺是最重要的芳香族胺之一,腐魚味,燃燒的火焰會生煙。
苯胺是最重要的胺類物質之一。主要用於製造染料、藥物、樹脂,還可以用作橡膠硫化促進劑等。它本身也可作為黑色染料使用。其衍生物甲基橙可作為酸鹼滴定用的指示劑。
結構
[編輯]
苯胺的氨基是有輕微三角錐化的立體結構,氮的雜化程度介於sp2和sp3之間。結果便是,氮的孤對電子處於具有較多p特性的spx雜化軌道中。由於孤對電子與苯環的離域,苯胺中的氨基相比於脂肪胺中氨基的更平坦(即,H-N-H平面與苯環平面的二面角更大)。這樣的幾何結構反映了兩個互相影響的因素:1)氮孤在s佔比更大的軌道中穩定化,傾向於三角錐形(通常s軌的能量更低),而2)氮的孤對電子在芳環上的離域又有利於分子的平面化(當為純p軌與苯環π鍵軌道重合面積最大)。[1]
同樣的,給電子基團取代的苯胺衍生物的氨基立體結構更加三角錐化,而吸電子基取代的則更加平面化。苯胺中大約有12%的孤對電子是s軌特徵,對應為sp7.3雜化。[1] (作為參考,烷基胺上氮的孤對電子雜化方式接近於sp3。)
C-N鍵與H-N-H角平分線的夾角為142.5°。[2](作為參考,sp3雜化的甲胺的該夾角約為125°,sp2雜化的甲酰胺的該夾角為180°。)
C-N鍵鍵長也相應地變短,在苯胺中C-N鍵長為1.41Å,[3]在環己胺中為1.47Å,[4],確認了氮與碳間存在的離域效應。[5]
製備
[編輯]工業上製取苯胺涉及以下兩步。首先,苯在 50~60 °C 在濃硫酸和濃硝酸的混合物硝化,得到硝基苯;後者再被催化加氫還原(反應溫度通常在 200~300 °C 之間)。
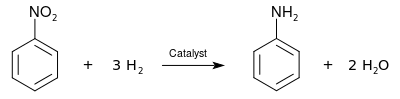 [6]
[6]商業上,有三檔純度不同的苯胺通過標牌區分:藍色標牌的阿尼林油(高純苯胺);紅色標牌的阿尼林油(混有一定量的甲基苯胺);以及製取番紅用的苯胺,通常是從品紅中蒸餾出的。[來源請求]
物理性質
[編輯]- 外觀與性狀:無色或微黃色油狀液體,有強烈氣味。
- 熔點(℃):-6.2
- 相對密度(水=1):1.02
- 沸點(℃):184.4
- 相對蒸氣密度(空氣=1):3.22
- 分子式:C6H7N
- 分子量:93.128
- 粘度,CP 3.71(25℃)
- CAS號62-53-3
- 飽和蒸氣壓(kPa):2.00(77℃)
- 燃燒熱(kJ/mol):3389.8
- 臨界溫度(℃):425.6
- 臨界壓力(MPa):5.30
- 辛醇/水分配係數的對數值:0.94
- 折光率1.5863
- 閃點(℃):70
- 爆炸上限%(V/V):11.0
- 爆炸下限%(V/V):1.3
- 溶解性:微溶於水,溶於乙醇、乙醚、苯。
化學性質
[編輯]弱鹼性,由於苯環穩定了氮上的孤對電子,使其鹼性較脂肪族胺類低了許多。苯胺能與鹽酸化合生成鹽酸鹽,與硫酸化合成硫酸鹽。能起鹵化、乙酰化、重氮化等作用。遇明火、可燃。
鹼性
[編輯]氮上孤對電子與苯環上π電子相互構成一個大的共軛系統而變得穩定,與此同時離域也降低了氮上電子云的密度,減弱了其質子化的能力,因此苯胺的鹼性比環己胺弱103倍(雜化時含有較多的s成分時對氮孤的控制更強)。 苯胺會與強酸反應形成苯銨陽離子(C6H5-NH3 +),也會與鋅、鋁、鐵(III)離子形成鹽類沉澱,加熱其鹽類會釋放氨氣。[來源請求]
化學活性
[編輯]氨基是活化基團,它能使苯環活化。苯胺更容易進行親電取代反應,如和溴水作用,立刻形成2,4,6-三溴苯胺。如果要得到一溴產物,則需要用乙酸酐對氨基保護,形成乙酰苯胺,然後再和溴反應,水解之後得到對溴苯胺。[8]
生成重氮鹽
[編輯]用處
[編輯]苯胺主要用於生產4,4'-二氨基二苯甲烷。這個二胺之後會和光氣反應,生成聚氨酯的前體二苯基甲烷二異氰酸酯。[7]
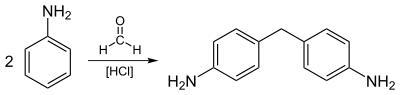
大部分苯胺都用於生產聚氨酯的前體4,4'-二氨基二苯甲烷。
苯胺的其它用處包括生產橡膠加工化學品(9%)、除草劑(2%)和染料(2%)。[9]它還可以合成像是對乙酰氨基酚的藥物,而苯胺在染料工業中最主要的用途是生產靛藍。[7]

生化特性
[編輯]- 健康危害:該品主要引起高鐵血紅蛋白血症、溶血性貧血和肝、腎損害。易經皮膚吸收。急性中毒:患者口唇、指端、耳廓紫紺,有頭痛、頭暈、噁心、嘔吐、手指發麻、精神恍惚等;重度中毒時,皮膚、粘膜嚴重青紫,呼吸困難,抽搐,甚至昏迷,休克。出現溶血性黃疸、中毒性肝炎及腎損害。可有化學性膀胱炎。眼接觸引起結膜角膜炎。慢性中毒:患者有神經衰弱綜合症表現,伴有輕度紫紺、貧血和肝、脾腫大。皮膚接觸可引起濕疹。
- 環境危害:對環境有危害,對水體可造成污染。
- 燃爆危險:該品可燃,有毒。
- 毒理:苯胺經呼吸道、消化道、皮膚進入人體。生產中經皮膚吸入為主要途徑。溫度、濕度增加,吸收增加。入血後經氧化作用形成對氨基酚由尿排出。尿中對氨基酚量與高鐵血紅蛋白量平行關係。呼吸道吸入的少量苯胺以原形有呼吸道排出。苯胺的毒性主要與其代謝產物苯胲有關,苯基羥胺很強的高鐵血紅蛋白形成能力,使血紅蛋白失去攜氧能力,機體缺氧、溶血,引起中樞神經系統、心血管系統和其他臟器損傷。
參見
[編輯]參考文獻
[編輯]- ^ 1.0 1.1 Alabugin, Igor V. (Professor). Stereoelectronic effects : a bridge between structure and reactivity. Chichester, UK. 2016. ISBN 978-1-118-90637-8. OCLC 957525299.
- ^ 1937-, Carey, Francis A. Organic chemistry 7th. Boston: McGraw-Hill Higher Education. 2008. ISBN 9780073047874. OCLC 71790138.
- ^ Zhang, Huaiyu; Jiang, Xiaoyu; Wu, Wei; Mo, Yirong. Electron conjugation versus π-π repulsion in substituted benzenes: why the carbon-nitrogen bond in nitrobenzene is longer than in aniline. Physical Chemistry Chemical Physics. April 28, 2016, 18 (17): 11821–11828 [2021-11-08]. Bibcode:2016PCCP...1811821Z. ISSN 1463-9084. PMID 26852720. doi:10.1039/c6cp00471g. (原始內容存檔於2021-12-18).
- ^ Raczyńska, Ewa D.; Hallman, Małgorzata; Kolczyńska, Katarzyna; Stępniewski, Tomasz M. On the Harmonic Oscillator Model of Electron Delocalization (HOMED) Index and its Application to Heteroatomic π-Electron Systems. Symmetry. 2010-07-12, 2 (3): 1485–1509. Bibcode:2010Symm....2.1485R. ISSN 2073-8994. doi:10.3390/sym2031485
 (英語).
(英語).
- ^ G. M. Wójcik "Structural Chemistry of Anilines" in Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. 2007, Wiley-VCH, Weinheim. doi:10.1002/9780470682531.pat0385.
- ^ Caskey, Douglas C.; Chapman, Douglas W., Process for the preparation of arylhydroxylamines, Apr 24, 1985 [2016-06-16], (原始內容存檔於2016-10-20)
- ^ 7.0 7.1 7.2 Kahl, Thomas; Schröder, K. W.; Lawrence, F. R.; Elvers, Barbara; Höke, Hartmut; Pfefferkorn, R.; Marshall, W. J. Aniline. Ullmann, Fritz (編). Ullmann's encyclopedia of industrial chemistry. Wiley: New York. 2007 [2022-08-08]. ISBN 978-3-527-20138-9. OCLC 11469727. doi:10.1002/14356007.a02_303. (原始內容存檔於2022-11-18).
- ^ 天津大學有機化學教研室. 《有機化學》第五版. 高等教育出版社, 2014. pp 491-492. ISBN 978-7-04-039598-3
- ^ Aniline. The Chemical Market Reporter. [2007-12-21]. (原始內容存檔於2002-02-19).
| |||||||||||||||||||||||||||||||||||||
|






