异氰酸
| 异氰酸 | |
|---|---|
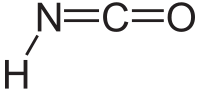
| |

| |
| IUPAC名 Isocyanic acid | |
| 识别 | |
| CAS号 | 75-13-8 420-05-3(氰酸) ? |
| PubChem | 6347 |
| ChemSpider | 6107 |
| SMILES |
|
| InChI |
|
| InChIKey | OWIKHYCFFJSOEH-UHFFFAOYAE |
| 性质 | |
| 化学式 | HNCO |
| 摩尔质量 | 43.03 g·mol⁻¹ |
| 外观 | 无色液体或气体(沸点接近室温) |
| 密度 | 1.14 g/cm3 (20 °C) |
| 熔点 | -86 °C [1] |
| 沸点 | 23.5 °C |
| 溶解性(水) | 可溶 |
| 溶解性 | 可溶于苯、甲苯、醚 |
| 危险性 | |
| 主要危害 | 有毒 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
异氰酸是一种无机化合物,分子式为HNCO,通常写作 H–N=C=O。它是无色的物质,有挥发性,有毒,沸点为 23.5 °C。为氰酸的互变异构体。
异氰酸对应的阴离子 [N=C=O]−
和氰酸一样,也被称作氰酸盐。相关的官能团 –N=C=O 叫做异氰酸酯,是氰酸酯 –O–C≡N、雷酸盐 –O–N+≡C−和氧化腈 –C≡N+–O−的异构体。[2]
异氰酸于 1830年被尤斯图斯·冯·李比希和弗里德里希·维勒发现。[3]
异氰酸是含有碳、氢、氮和氧这四个在有机化学和生物学中最常见的原子组成的稳定分子里,最简单的。它也是四个化学式为 HOCN 的化合物中唯一稳定的,其它三个是氰酸 H–O–C≡N 、雷酸 H–C≡N+–O−[4]和异雷酸 H–O–N+≡C−。[2][5]
结构
[编辑]尽管根据价键理论,异氰酸可以被写成 HN=C=O,气态红外光谱显示 2268.8 cm−1的震动,由碳-氮三键引起。[6][7]因此, H≡C−O− 才是主要的共振异构体。
性质
[编辑]物理性质
[编辑]纯异氰酸的熔点为 −86.8 °C ,沸点为 23.5 °C,所以在常温下有挥发性。[8][9]
酸性
[编辑]- HNCO ⇌ H+ + NCO−
水解
[编辑]- HNCO + H2O → CO2 + NH3
聚合反应
[编辑]在高浓度下,异氰酸会聚合成三聚体三聚氰酸和1,3,5-三亚胺基-2,4,6-三氧六环,一种聚合物。它们可以简单地从液态或气态反应物中分离。三聚氰酸加热时会分解成异氰酸。[8]
在溶液里的稳定性
[编辑]反应
[编辑]- HNCO + RNH2 → RNHC(O)NH2.
这个反应叫做碳酰胺化反应。
互变异构
[编辑]异氰酸有一个互变异构体——氰酸 HOCN,其中氧原子(而不是异氰酸的氮原子)与氢原子连接。它对分解不稳定,但在溶液中和异氰酸形成平衡,有3%的异氰酸以氰酸形式存在。振动光谱表明氮和碳原子之间存在三键。[12]
低温光解含有HNCO的固体可以产生氰酸 H-O-C≡N。[13]人们尚未分离出纯氰酸,而异氰酸是所有溶剂中的主要存在形式。[11]
制备
[编辑]异氰酸可以由氰酸盐,例如氰酸钾和气态氯化氢或是像草酸之类的酸反应而成。[14]
- H+ + NCO- → HNCO
HNCO 也可以由三聚体三聚氰酸热分解而成:
- C3H3N3O3 → 3 HNCO
- OC(NH2)2 → HNCO + NH3
其中的异氰酸会迅速聚合成三聚氰酸。
存在
[编辑]异氰酸也在多种烟中用质谱法被检测到,包括烟雾和烟气。异氰酸易溶于水,会对肺部构成健康风险。[15]
参考资料
[编辑]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ^ 2.0 2.1 William R. Martin and David W. Ball (2019): "Small organic fulminates as high energy materials. Fulminates of acetylene, ethylene, and allene". Journal of Energetic Materials, volume 31, issue 7, pages 70-79. doi:10.1080/07370652.2018.1531089
- ^ Liebig, J.; Wöhler, F. Untersuchungen über die Cyansäuren. Ann. Phys. 1830, 20 (11): 394 [2021-03-28]. Bibcode:1830AnP....96..369L. doi:10.1002/andp.18300961102. (原始内容存档于2018-08-06).
- ^ Kurzer, Frederick. Fulminic Acid in the History of Organic Chemistry. Journal of Chemical Education. 2000, 77 (7): 851–857. Bibcode:2000JChEd..77..851K. doi:10.1021/ed077p851.
- ^ 5.0 5.1 Donghui Quan, Eric Herbst, Yoshihiro Osamura, and Evelyne Roueff (2010): "Gas-grain modeling of isocyanic acid (HNCO), cyanic acid (HOCN), fulminic acid (HCNO), and isofulminic acid (HONC) in assorted interstellar environments" The Astrophysical Journal, volume 725, issue 2, pages doi:10.1088/0004-637X/725/2/2101
- ^ Nakamoto, part A, p 190
- ^ Teles, Joaquim Henrique; Maier, Günther; Andes Hess, B.; Schaad, Lawrence J.; Winnewisser, Manfred; Winnewisser, Brenda P. The CHNO Isomers. Chemische Berichte. 1989, 122 (4): 753–766. doi:10.1002/cber.19891220425.
- ^ 8.0 8.1 Greenwood, p323
- ^ Wells, p 722
- ^ IUPAC SC-Database (页面存档备份,存于互联网档案馆) A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ 11.0 11.1 A. S. Narula, K. Ramachandran “Isocyanic Acid” in Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, New York. doi:10.1002/047084289X.ri072m Article Online Posting Date: April 15, 2001.
- ^ Teles, Joaquim Henrique; Maier, Günther; Andes Hess, B.; Schaad, Lawrence J.; Winnewisser, Manfred; Winnewisser, Brenda P. The CHNO Isomers. Chem. Ber. 1989, 122 (4): 1099–0682. doi:10.1002/cber.19891220425.
- ^ Jacox, M.E.; Milligan, D.E. Low-Temperature Infrared Study of Intermediates in the Photolysis of HNCO and DNCO. Journal of Chemical Physics. 1964, 40 (9): 2457–2460. Bibcode:1964JChPh..40.2457J. doi:10.1063/1.1725546.
- ^ Fischer, G.; Geith, J.; Klapötke, T. M.; Krumm B. Synthesis, Properties and Dimerization Study of Isocyanic Acid (PDF). Z. Naturforsch. 2002, 57b (1): 19–25 [2021-03-29]. S2CID 37461221. doi:10.1515/znb-2002-0103. (原始内容存档 (PDF)于2012-02-05).
- ^ Preidt, Robert. Chemical in Smoke May Pose Health Risk. MyOptumHealth. AccuWeather. [14 September 2011]. (原始内容存档于2011-11-21).
外部链接
[编辑]- Walter, Wolfgang. Organic Chemistry: A Comprehensive Degree Text and Source Book. Chichester: Albion Publishing. 1997: 364 [2008-06-21]. ISBN 978-1-898563-37-2. (原始内容存档于2022-04-05).
- Cyanic acid (页面存档备份,存于互联网档案馆) from NIST Chemistry WebBook (accessed 2006-09-09)
| |||||||
|
